Foram encontradas 35 questões.
Acerca do histórico e do perfil institucional do IFPR, conforme consta do Plano de Desenvolvimento Institucional do
IFPR, é correto afirmar que o IFPR:
Provas
Questão presente nas seguintes provas
Um vídeo que mostra dois homens da República Democrática do
Congo manuseando uma rocha de aparência metálica viralizou
recentemente nas redes sociais devido a comentários que atribuíram
à rocha misteriosa o mineral fictício vibranium do universo Marvel. No
vídeo, quando um homem conecta as extremidades de um fio a duas
regiões da rocha, uma lâmpada LED se acende, demonstrando uma
diferença de potencial e passagem de corrente elétrica. O que causa a
diferença de potencial ainda não foi esclarecido, mas se especula que
a rocha contenha minerais ricos em nióbio e cobalto, comumente
extraídos naquele país. Ao lado, são mostrados diagramas de Latimer
de espécies de cobalto e nióbio.
Admitindo-se que essas espécies possam estar participando do processo responsável pelo acendimento do LED, que opera entre 1,5 e 2,7 V, a possível pilha formada envolve:
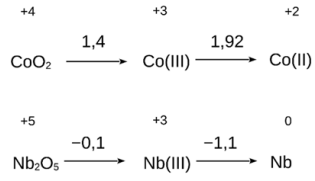
Admitindo-se que essas espécies possam estar participando do processo responsável pelo acendimento do LED, que opera entre 1,5 e 2,7 V, a possível pilha formada envolve:

Provas
Questão presente nas seguintes provas
Após manusear peixes, o cheiro desagradável que fica nas mãos pode ser eliminado utilizando-se soluções de
característica ácida, como suco de limão ou vinagre, devido à reação de neutralização dos compostos nitrogenados
que ficam nas mãos. A avaliação da basicidade de um composto é realizada pelo valor de pKa do ácido
conjugado (pKaH). A basicidade de cinco compostos nitrogenados foi avaliada: acetonitrila, anilina, íon amideto,
cicloexilamina e difenilamina.
A ordem crescente de pKaH é:
A ordem crescente de pKaH é:
Provas
Questão presente nas seguintes provas
Dados de energia livre de Gibbs são bastante utilizados para definir
condições de reação em processos tecnológicos e industriais. A
aplicação desses dados na síntese de amônia pelo processo
Haber-Bosch é provavelmente a mais explorada nos livros didáticos.
A figura ao lado consiste num gráfico da variação de energia livre (ΔG)
em função da temperatura (T), onde estão cinco curvas referentes a
diferentes reações químicas. Essas curvas estão associadas a
situações simplificadas, em que não ocorrem mudanças de estado
físico na faixa de temperatura do gráfico.
A variação de energia livre relacionada à reação de combustão do etanol, apresentada pela equação a seguir, é mais próxima do comportamento descrito pela seguinte letra (correspondente no gráfico):
C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(g)
A variação de energia livre relacionada à reação de combustão do etanol, apresentada pela equação a seguir, é mais próxima do comportamento descrito pela seguinte letra (correspondente no gráfico):

C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(g)
Provas
Questão presente nas seguintes provas
Ao se perguntar às pessoas de um grupo quais suas cores favoritas, a maioria responderá azul. Provavelmente, por
essa razão, a descoberta acidental do pigmento azul da Prússia por Diesbach no começo do séc. XVIII foi uma criação
tão preciosa. Do seu uso nas artes, atualmente esse material encontra aplicações em medicamentos até janelas
eletrocrômicas. O material é formado pela combinação de Fe(III) (Fe, Z = 26) e o íon ferrocianeto [Fe(CN)6]4-, em que Fe(II)
está em campo octaédrico coordenado ao ligante de campo forte CN-
. A cor azul intensa é proveniente de uma transição
de intervalência entre Fe(III) e o íon ferrocianeto. Ao oxidar eletroquimicamente o ferrocianeto ao ferricianeto [Fe(CN)6]3-
, a cor desaparece. Esse fenômeno é explorado nas janelas eletrocrômicas.
Ventura, D. O lendário azul da Prússia, cor que pode salvar ou tirar vidas. Disponível em www.bbc.com. Adaptado.
A distribuição eletrônica na valência do par associado à conversão eletroquímica de oxidação mencionada no texto é descrita por:
Ventura, D. O lendário azul da Prússia, cor que pode salvar ou tirar vidas. Disponível em www.bbc.com. Adaptado.
A distribuição eletrônica na valência do par associado à conversão eletroquímica de oxidação mencionada no texto é descrita por:
Provas
Questão presente nas seguintes provas
- Química CinéticaTransformações Químicas
- Sistemas de EquilíbrioSistemas Homogêneos: Equilíbrio Químico na Água
Os cientistas usam a tabela periódica para acessar rapidamente informações sobre um elemento, como seu símbolo,
número ou massa atômicos. A organização da tabela periódica também permite avaliar tendências nas propriedades
atômicas, tais como energia de ionização (EI) e eletronegatividade de Pauling (χP), ou mesmo propriedades dos
respectivos cátions bivalentes, como dureza absoluta de Pearson (η) e acidez (pKa). No grupo 12 da tabela temos, de
cima para baixo, os elementos zinco, cádmio e mercúrio.
Analisando as propriedades mencionadas no texto, para o grupo 12 e partindo do zinco em direção ao mercúrio, é possível prever tendência de:
Analisando as propriedades mencionadas no texto, para o grupo 12 e partindo do zinco em direção ao mercúrio, é possível prever tendência de:
Provas
Questão presente nas seguintes provas
A contaminação por mercúrio do ambiente e das populações ribeirinhas na região amazônica, causada pelo garimpo
ilegal, tem se agravado e alcançado níveis alarmantes. Mais recentemente, esse problema tem sido noticiado
paralelamente a outras denúncias de crimes contra povos indígenas que vivem nas reservas da região. O mercúrio
metálico (Hg) usado na extração do ouro converte-se em outras espécies, comumente na forma de cloretos, como
cloreto mercuroso (Hg2Cl2), cloreto mercúrico (HgCl2) e cloreto de metilmercúrio (CH3HgCl). O perigo e os riscos
associados a essas espécies são descritos nas fichas de segurança, e algumas informações estão colocadas no
quadro a seguir.

Entre os compostos listados, verifica-se maior perigo associado à espécie:

Entre os compostos listados, verifica-se maior perigo associado à espécie:
Provas
Questão presente nas seguintes provas
- Química OrgânicaFunções Oxigenadas: Álcool, Fenol e Enol
- Química OrgânicaFunções Oxigenadas: Cetona, Aldeído, Éter, Éster, Ácido Carboxílico etc.
- Química OrgânicaReações OrgânicasReações Orgânicas: Substituição, Adição e Eliminação
- Química OrgânicaReações OrgânicasReações Orgânicas: Oxidação, Redução e Polimerização
A química teve impacto na nossa vida cotidiana em diversos momentos e segmentos, inclusive revolucionando a
maneira de nos vestirmos. O surgimento dos tecidos sintéticos alterou profundamente a indústria têxtil. Os tecidos de
poliéster são um dos principais exemplos. Na reação de polimerização por acilação, mostrada a seguir, são
empregados dois monômeros.
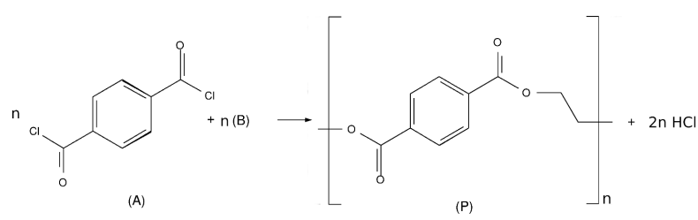
Para obtenção do produto (P), o derivado de cloreto de acila (A) deve reagir com o reagente (B), que é o:

Para obtenção do produto (P), o derivado de cloreto de acila (A) deve reagir com o reagente (B), que é o:
Provas
Questão presente nas seguintes provas
- Química CinéticaRepresentação das Transformações Químicas
- Química InorgânicaSoluções e Substâncias InorgânicasSubstâncias Inorgânicas: dissociação iônica e ionização, conceitos de ácido-base
O texto a seguir é referência para a questão.
Pesquisas suportadas pela NASA têm usado um modelo para prever a concentração de óxido nitroso (N2O) na atmosfera dos
planetas. Na Terra, o N2O atmosférico é proveniente de reações decorrentes da dissociação fotoquímica do ozônio, mas também é
liberado por organismos vivos. Assim, se a concentração desse gás na atmosfera de um planeta atingisse níveis detectáveis por um
telescópio, isso poderia ser um indício de sinal de vida. O óxido nítrico (NO) atmosférico, por sua vez, pode ter origem biogênica ou
antropogênica, mas, assim como o óxido nitroso, reage com ozônio gerando outros óxidos de nitrogênio.
Schwieterman, E.W. et al. Evaluating the Plausible Range of N2O Biosignatures on Exo-Earths: An Integrated Biogeochemical, Photochemical,
and Spectral Modeling Approach, Disponível em: https://doi.org/10.48550/arXiv.2210.01669. Adaptado.
Dados: N (Z=7); O (Z=8)
Provas
Questão presente nas seguintes provas
O texto a seguir é referência para a questão.
Pesquisas suportadas pela NASA têm usado um modelo para prever a concentração de óxido nitroso (N2O) na atmosfera dos
planetas. Na Terra, o N2O atmosférico é proveniente de reações decorrentes da dissociação fotoquímica do ozônio, mas também é
liberado por organismos vivos. Assim, se a concentração desse gás na atmosfera de um planeta atingisse níveis detectáveis por um
telescópio, isso poderia ser um indício de sinal de vida. O óxido nítrico (NO) atmosférico, por sua vez, pode ter origem biogênica ou
antropogênica, mas, assim como o óxido nitroso, reage com ozônio gerando outros óxidos de nitrogênio.
Schwieterman, E.W. et al. Evaluating the Plausible Range of N2O Biosignatures on Exo-Earths: An Integrated Biogeochemical, Photochemical,
and Spectral Modeling Approach, Disponível em: https://doi.org/10.48550/arXiv.2210.01669. Adaptado.
N2O(g) + O3(g) ⇌ N2O4(g) K = 4,4 × 102
Num sistema em equilíbrio, as concentrações de O3 e N2O4 são, respectivamente, 6,4 x 10-3 mol L-1 e 0,25 mol L-1. Qual é o valor da concentração de N2O?
Provas
Questão presente nas seguintes provas
Cadernos
Caderno Container