Foram encontradas 100 questões.
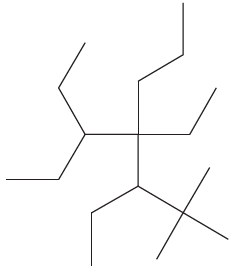
A nomenclatura, segundo a IUPAC, do hidrocarboneto acima é
Provas
Questão presente nas seguintes provas
A sílica-gel é um coloide que faz parte de um grupo de sistemas coloidais denominado gel, em que a fase dispersante e a fase dispersa são, respectivamente,
Provas
Questão presente nas seguintes provas
O quadro a seguir mostra um conjunto de dispersões aquosas preparadas pela adição de 5 g do disperso em 100 mL de água pura.
| Dispersão | Disperso | Dispersante |
| X | Leite em pó | Água |
| Y | NaCl(s) | Água |
| Z | Mg(OH)2 | Água |
As dispersões X, Y e Z podem ser classificadas, respectivamente, como
Provas
Questão presente nas seguintes provas
Os calores de combustão para o metano e o etanol, substâncias constituintes dos combustíveis gás natural e álcool, respectivamente, são apresentados na tabela abaixo
| Combustível | Calor de Combustão (kJ mol–1) |
| Gás Natural (CH4) | −8,90 !$ \cdot !$102 |
| Álcool (C2H5OH) | −1,38 !$ \cdot !$103 |
O volume, em litros, de gás natural, medido nas CNTP, que precisa ser queimado para produzir a mesma quantidade de calor que resulta da combustão de 1,0 mol de etanol é igual a
Provas
Questão presente nas seguintes provas
A decomposição térmica do nitrato de amônio pode ser representada pela seguinte equação química:
NH4NO3(s) !$ \rightarrow !$ N2O(g) + 2H2O(g)
As entalpias padrão de formação dos compostos NH4NO3(s), N2O(g) e H2O(g) são iguais a -365,3 kJ mol–1, +81,6 kJ mol–1 e −241,8 kJ mol–1, respectivamente. Sendo !$ \Delta !$H0, !$ \Delta !$S0 e !$ \Delta !$G0, respectivamente, as variações de entalpia, entropia e energia livre padrão para a reação, a decomposição do nitrato de amônio em óxido de dinitrogênio e água apresenta
Provas
Questão presente nas seguintes provas
Seja a representação da reação iônica, não balanceada, abaixo.
x Cr2O7 2– (aq) + y H+ (aq) + z I1– (aq) !$ \rightarrow !$ w Cr3+ (aq) + k I2(g) + p H2O(l)
A soma total dos coeficientes estequiométricos mínimos e inteiros x, y, z, w, k e p na equação química balanceada será igual a
Provas
Questão presente nas seguintes provas
Lâminas de cobre foram mergulhadas em soluções 1,0 mol L−1 de Pb(NO3)2, AgNO3 e NiSO4. Sendo dados os potenciais padrão de redução:
!$ ε^0 \left \lfloor Pb^{2+}/Pb_{(s)}\right \rfloor \quad =-0,13 \, V !$; !$ ε^0 \left \lfloor Cu^{2+}/Cu_{(s)}\right \rfloor \quad =+0,34 \, V !$; !$ ε^0 \left \lfloor Ag^+/Ag_{(s)}\right \rfloor \quad =+0,80 \, V !$ e !$ ε^0 \left \lfloor Ni^{2+}/Ni_{(s)}\right \rfloor \quad =-0,23 \, V !$,
ocorrerá oxidação da lâmina de cobre APENAS na(s) solução(ões) de
Provas
Questão presente nas seguintes provas
Sendo dadas as seguintes semiequações de redução seus respectivos potenciais padrão de redução (!$ ε !$0):
MnO4–(aq) + 8H+(aq) + 5e– !$ \rightleftharpoons !$ Mn2+(aq) + 4H2O(l) !$ ε !$0 = +1,51 V
Br2 (g) + 2e– !$ \rightleftharpoons !$ 2Br–(aq) !$ ε !$0 = +1,23 V
NO3+(aq) + 4H+(aq) + 3e– !$ \rightleftharpoons !$ NO(g) + 2H2O(l) !$ ε !$0 = +0,96 V
As seguintes afirmações são apresentadas:
I – haverá reação espontânea quando NO(g) for borbulhado em solução aquosa ácida (pH = 0) de KMnO4 1,0 mol L–1;
II – haverá reação espontânea quando Br2(g) for borbulhado em solução aquosa ácida (pH = 0) de KMnO4 1,0 mol L–1;
III – o bromo apresenta poder oxidante maior que o de uma solução de ácido nítrico 1,0 mol L–1;
IV – uma solução de ácido nítrico 1,0 mol L–1 apresenta poder oxidante maior que o de uma solução aquosa ácida (pH = 0) de KMnO4 1,0 mol L–1.
Estão corretas APENAS as afirmativas
Provas
Questão presente nas seguintes provas
Seja a equação termoquímica a seguir.
CO2(g) + H2(g) !$ \rightarrow !$ CO(g) + H2O(g) !$ \Delta !$H0 = +41,2 KJ mol–1
Sabendo-se que os calores de formação padrão para H2O(g) e Fe2O3(s) são iguais a −241,8 kJ×mol–1 e −824,8 kJ x mol–1, respectivamente, a variação de entalpia no estado padrão para a reação
Fe2O3(s) + 3CO(g) !$ \rightarrow !$ 2Fe(s) + 3CO2(g)
será igual a
Provas
Questão presente nas seguintes provas
Duas amostras de metal foram testadas em laboratório através da análise do comportamento das mesmas na presença de ácidos fortes concentrados. Os resultados dos testes são apresentados a seguir.
| Metal | Reação com HCl concentrado | Reação com HNO3 concentrado |
| X | Não houve reação | Liberação de gás |
| Y | Liberação de gás | Liberação de gás |
Sabendo-se que:
NO3 – (aq) + 4H+(aq) + 3e– !$ \rightleftharpoons !$ NO(g)+2H2O(!$ \ell !$) !$ ε !$0 = +0,96 V
Cu2+(aq +2e– !$ \rightleftharpoons !$ Cu(s) !$ ε !$0 = +0,34 V
2H+(aq) + 2e– !$ \rightleftharpoons !$ H2(g) !$ ε !$0 = +0,00 V
Zn2+(aq) + 2e– !$ \rightleftharpoons !$ Zn(s) !$ ε !$0 = −0,76 V
De acordo com os resultados dos testes, o metal
Provas
Questão presente nas seguintes provas
Cadernos
Caderno Container