Foram encontradas 100 questões.
Considere as seguintes radiações eletromagnéticas:
I. Radiação Gama.
II. Radiação visível.
III. Radiação ultravioleta.
IV. Radiação infravermelho.
V. Radiação microondas.
Dentre estas radiações eletromagnéticas, aquelas que, via de regra, estão associadas a transições eletrônicas em moléculas são
Provas
Uma massa de 180 g de zinco metálico é adicionada a um erlenmeyer contendo solução aquosa de ácido clorídrico. Ocorre reação com liberação de gás que é totalmente coletado em um Balão A, de volume igual a 2L. Terminada a reação, restam 49 g de zinco metálico no erlenmeyer. A seguir, por meio de um tubo provido de torneira, de volumes desprezíveis, o Balão A é conectado a um Balão B, de volume igual a 4 L, que contém gás nitrogênio sob pressão de 3 atm. Considere que a temperatura é igual em ambos os balões e que esta é mantida constante durante todo o experimento. Abrindo-se a torneira do tubo de conexão entre os dois balões, ocorre a mistura dos dois gases. Após estabelecido o equilíbrio, a pressão nos dois balões pode ser expressa em função da constante dos gases (R) e da temperatura absoluta (T) por
Provas
Considere as seguintes configurações eletrônicas e respectivas energias da espécie atômica (A), na fase gasosa, na forma neutra, aniônica ou catiônica, no estado fundamental ou excitado:
I. !$ ns^2 np^5 (n + 1) s^2 !$; !$ E_I !$.
II. !$ ns^2 np^6 (n + 1) s^1 (n + 1)p^1 !$; !$ E_{II} !$.
III. !$ ns^2 np^4 (n + 1) s^2 !$; !$ E_{III} !$.
IV. !$ ns^2 np^5 !$; !$ E_{IV} !$.
V. !$ ns^2 np^6 (n + 1) s^2 !$; !$ E_V !$.
VI. !$ ns^2 np^6 !$; !$ E_{VI} !$.
VII. !$ ns^2 np^5 (n + 1) s^1 (n + 1)p^1 !$; !$ E_{VII} !$.
VIII.!$ ns^2 np^6 (n + 1) s^1 !$; !$ E_{VIII} !$.
Sabendo que !$ leftvert E_I ightvert !$ é a energia, em módulo, do primeiro estado excitado do átomo neutro (A), assinale a alternativa ERRADA.
Provas
Quatro copos (I, lI, III e IV) contêm, respectivamente, soluções aquosas de misturas de substâncias nas concentrações especificadas a seguir:
I. Acetato de sódio 0,1 moI L!$ ^{-1} !$ + Cloreto de sódio 0,1 moI L!$ ^{-1} !$.
II. Ácido acético 0,1 moI L!$ ^{-1} !$ + Acetato de sódio 0,1 mol L!$ ^{-1} !$.
III. Ácido acético 0,1 moI L!$ ^{-1} !$ + Cloreto de sódio 0,1 mol L!$ ^{-1} !$.
IV. Ácido acético 0,1 moI L!$ ^{-1} !$ + Hidróxido de amônio 0,1 moI L!$ ^{-1} !$.
Para uma mesma temperatura, qual deve ser a seqüência correta do pH das soluções contidas nos respectivos copos?
Dados eventualmente necessários: Constante de dissociação do ácido acético em água a 25 °C: !$ K_a = 1,8 × 10^{–5} !$.
Constante de dissociação do hidróxido de amônio em água a 25 °C: !$ K_b = 1,8 × 10^{–5} !$.
Provas
Considere as seguintes equações químicas:
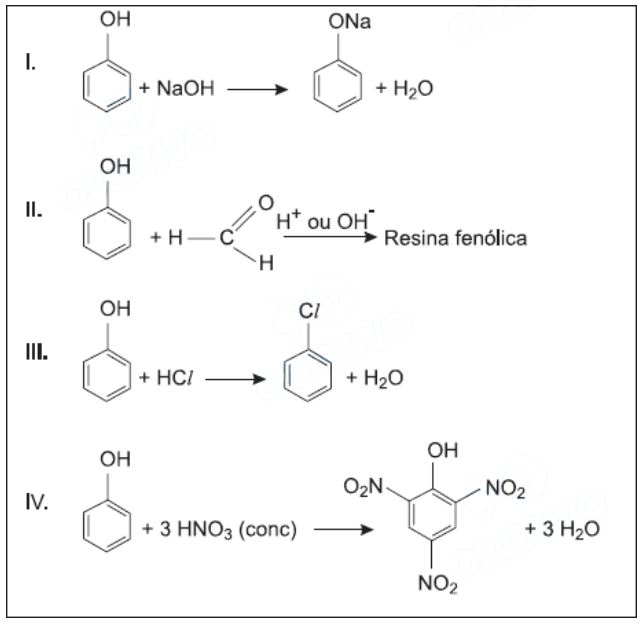
Das reações representadas pelas equações acima, aquela(s) que ocorre(m) nas condições-padrão é (são)
Provas
Uma mistura de 300 mL de metano e 700 mL de cloro foi aquecida no interior de um cilindro provido de um pistão móvel sem atrito, resultando na formação de tetracloreto de carbono e cloreto de hidrogênio. Considere todas as substâncias no estado gasoso e temperatura constante durante a reação. Assinale a opção que apresenta os volumes CORRETOS, medidos nas mesmas condições de temperatura e pressão, das substâncias presentes no cilindro após reação completa.

Provas
Na temperatura de 25°C e pressão igual a 1 atm, a concentração de !$ H_2S !$ numa solução aquosa saturada é de aproximadamente 0,1 moI L!$ ^{-1} !$. Nesta solução, são estabelecidos os equilíbrios representados pelas seguintes equações químicas balanceadas:
I. !$ H_2S(aq) ightleftarrows H^+(aq) + HS^–(aq) !$; !$ K_I(25°C)= 9,1 × 10^{–8} !$.
II. !$ HS^–(aq) ightleftarrows H^+(aq) + S^{2–}(aq) !$; !$ K_{II}(25°C) = 1,2 × 10^{–15} !$.
Assinale a informação ERRADA relativa a concentrações aproximadas (em moI L!$ ^{-1} !$) das espécies presentes nesta solução.
Provas
Considere os eletrodos representados pelas semi-equações químicas seguintes e seus respectivos potenciais na escala do eletrodo de hidrogênio (!$ E^0 !$) e nas condições-padrão:
I. !$ ln^+(aq) + e^–(CM) !$ !$ ightleftarrows !$ !$ ln(s) !$; !$ E^0_I = – 0,14V !$.
II. !$ In^2+ (aq) + e^ – (CM) !$ !$ ightleftarrows !$ !$ ln^+ (aq) !$; !$ E^0_{II} = – 0,40V !$.
III. !$ In^3+ (aq) + 2e^– (CM) !$ !$ ightleftarrows !$ !$ ln^+ (aq) !$; !$ E^0_{III} = – 0,44 V !$.
IV. !$ In^{3+} (aq) + e^–(CM) !$ !$ ightleftarrows !$ !$ In^2+ (aq) !$; !$ E^0_{IV} = – 0,49V !$.
Assinale a opção que contém o valor correto do potencial-padrão do eletrodo representado pela semi-equação !$ In^3+ (aq) + 3e^– (CM) ightleftarrows ln(s) !$.
Provas
Qual das opções a seguir apresenta a equação química balanceada para a reação de formação de óxido de ferro (II) sólido nas condições-padrão?
Provas
Considere os metais P, Q , R e S e quatro soluções aquosas contendo, cada uma, um dos íons !$ P^{p+}, Q^{q+}, R^{r+}, S^{s+} !$ (sendo p, q, r, s números inteiros e positivos). Em condições-padrão, cada um dos metais foi colocado em contato com uma das soluções aquosas e algumas das observações realizadas podem ser representadas
pelas seguintes equações químicas:
I. !$ qP + pQ^{q+} → !$ não ocorre reação.
II. !$ rP + pR^{r+} → !$ não ocorre reação.
III. !$ rS + sR^{r+} → sR + rS^{s+} !$.
IV. !$ sQ + qS^{s+} → qS+sQ^{q+} !$.
Baseado nas informações acima, a ordem crescente do poder oxidante dos íons !$ P^{p+}, Q^{q+}, R^{r+} e, S^{s+} !$ deve ser disposta da seguinte forma:
Provas
Caderno Container