Foram encontradas 40 questões.
De acordo com o disposto no artigo 9º, da Lei nº 9.784/1999, são legitimados como interessados no processo administrativo:
I. pessoas jurídicas que o iniciem como titulares de direitos ou interesses individuais.
II. associações representativas, no tocante a direitos e interesses individuais e coletivos.
III. as pessoas ou as associações legalmente constituídas quanto a direitos ou interesses difusos.
É correto o que está contido em
I. pessoas jurídicas que o iniciem como titulares de direitos ou interesses individuais.
II. associações representativas, no tocante a direitos e interesses individuais e coletivos.
III. as pessoas ou as associações legalmente constituídas quanto a direitos ou interesses difusos.
É correto o que está contido em
Provas
Questão presente nas seguintes provas
Das estruturas apresentadas abaixo, assinale a alternativa que apresenta um par em que ambas podem apresentar isômeros E-Z.
Provas
Questão presente nas seguintes provas
O cianeto de hidrogênio (HCN) é um ácido altamente venenoso, volátil e, em certas condições, pode ser até mesmo explosivo. Conhecendo a fórmula molecular deste composto, é correto afirmar que sua estrutura de Lewis mais estável é a seguinte:
Provas
Questão presente nas seguintes provas
- Química CinéticaRepresentação das Transformações Químicas
- Química InorgânicaSoluções e Substâncias InorgânicasSoluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais
Um técnico de laboratório deseja preparar 1,0L de uma solução de álcool etílico em água a 42% (m/v). Com essa finalidade, ele, primeiro, preparou 1,5L de uma solução estoque com 1,25L de uma solução alcoólica a 84% (m/v) diluído em água; a solução estoque também poderia ser utilizada para a limpeza do laboratório. Em seguida, ele preparou, a partir da solução estoque, a solução inicialmente desejada. Diante do exposto, é possível afirmar que o volume de solução estoque utilizado para preparar a solução de álcool etílico a 42% (m/v) é de
Provas
Questão presente nas seguintes provas
- Química CinéticaRepresentação das Transformações Químicas
- Química InorgânicaSoluções e Substâncias InorgânicasSoluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais
Para determinar a quantidade de iodo presente em 10,0mL de uma solução estoque, um técnico de laboratório utilizou 16,00mL de solução padrão de tiossulfato de sódio (Na2S2O3) titulante a uma concentração de 0,0100 mol.L-1 . Sabe-se que a equação química que representa a reação do iodo com tiossulfato de sódio é a seguinte:
Na2S2O3(aq)+ I2(aq) → Na2S4O6(aq)+ NaI(aq)
Diante do exposto, assinale a alternativa que apresenta a concentração de iodo presente na solução estoque.
Na2S2O3(aq)+ I2(aq) → Na2S4O6(aq)+ NaI(aq)
Diante do exposto, assinale a alternativa que apresenta a concentração de iodo presente na solução estoque.
Provas
Questão presente nas seguintes provas
Um grupo de estudantes determinou a velocidade de uma reação em função do aumento da concentração de quatro dos reagentes genéricos A, B, C e D. Ao plotar os resultados do experimento, eles obtiveram um gráfico da velocidade da reação em função da concentração de cada um dos reagentes, obtendo quatro retas. Observe o gráfico abaixo.
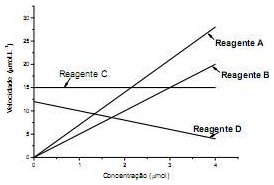
Tendo em vista os resultados do gráfico acima, é incorreto afirmar que o(a)

Tendo em vista os resultados do gráfico acima, é incorreto afirmar que o(a)
Provas
Questão presente nas seguintes provas
Observe os efeitos do deslocamento do equilíbrio químico que ocorre em duas soluções, cujos sistemas apresentam as respectivas equações de equilíbrio:
Equação de Equilíbrio da Solução 1:
2 CrO4-2 (aq) + 4 H+ (aq) Cr2O7 -2(aq) + 2 H2O (l)
Cr2O7 -2(aq) + 2 H2O (l)
Equação de Equilíbrio da Solução 2:
[CoCl 4] -2 (aq) + 4H2O(l) [Co(H2O)4Cl 2](aq) + 2 Cl-(l) ΔH<0
[Co(H2O)4Cl 2](aq) + 2 Cl-(l) ΔH<0
Com base nas informações acima, foram feitos quatro experimentos, com as duas soluções, levando-se em conta as condições para observação do deslocamento do equilíbrio químico. Os resultados foram tabelados abaixo.
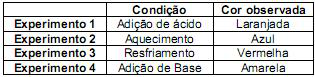
São informações corretas a respeito do estudo efetuado acima, exceto uma. Assinale a alternativa que a apresenta.
Equação de Equilíbrio da Solução 1:
2 CrO4-2 (aq) + 4 H+ (aq)
 Cr2O7 -2(aq) + 2 H2O (l)
Cr2O7 -2(aq) + 2 H2O (l) Equação de Equilíbrio da Solução 2:
[CoCl 4] -2 (aq) + 4H2O(l)
 [Co(H2O)4Cl 2](aq) + 2 Cl-(l) ΔH<0
[Co(H2O)4Cl 2](aq) + 2 Cl-(l) ΔH<0 Com base nas informações acima, foram feitos quatro experimentos, com as duas soluções, levando-se em conta as condições para observação do deslocamento do equilíbrio químico. Os resultados foram tabelados abaixo.

São informações corretas a respeito do estudo efetuado acima, exceto uma. Assinale a alternativa que a apresenta.
Provas
Questão presente nas seguintes provas
- Química InorgânicaSoluções e Substâncias InorgânicasSubstâncias Inorgânicas: dissociação iônica e ionização, conceitos de ácido-base
As teorias sobre ácido-base podem explicar uma série de efeitos cotidianos e também auxiliam na otimização dos processos industriais. Com base na teoria de ácido-base de Bronsted-Lowry, são propostas as seguintes equações:
Equação 1:
NH4 + (aq) + OH- (aq) NH3(aq) +H2O(l)
NH3(aq) +H2O(l)
Equação 2:
HSO4 - (aq) + HCO3-(aq) SO4 2- (aq) + H2CO3(aq)
SO4 2- (aq) + H2CO3(aq)
São pares de base e base conjugada de Bronsted-Lowry, respectivamente, em cada equação:
Equação 1:
NH4 + (aq) + OH- (aq)
 NH3(aq) +H2O(l)
NH3(aq) +H2O(l) Equação 2:
HSO4 - (aq) + HCO3-(aq)
 SO4 2- (aq) + H2CO3(aq)
SO4 2- (aq) + H2CO3(aq) São pares de base e base conjugada de Bronsted-Lowry, respectivamente, em cada equação:
Provas
Questão presente nas seguintes provas
A quantidade de sulfato de sódio (Na2SO4) presente em uma solução pode ser determinada por uma solução de cloreto de bário (BaCl2). A equação química que representa esta determinação é a seguinte:
Na2SO4(aq) + BaCl2 (aq) → NaCl(aq) + BaSO4 (s)
(Dados de massas atômicas (u): Na = 23; S = 32; O = 16; Ba = 137; Cl = 35,5)
Se 50,00mL da solução de sulfato de sódio consome 12,25mL de uma solução a 0,02mol/L de cloreto de bário, assinale a alternativa que apresenta a massa de sulfato de sódio presente.
Na2SO4(aq) + BaCl2 (aq) → NaCl(aq) + BaSO4 (s)
(Dados de massas atômicas (u): Na = 23; S = 32; O = 16; Ba = 137; Cl = 35,5)
Se 50,00mL da solução de sulfato de sódio consome 12,25mL de uma solução a 0,02mol/L de cloreto de bário, assinale a alternativa que apresenta a massa de sulfato de sódio presente.
Provas
Questão presente nas seguintes provas
1,5225g de um sólido com a fórmula genérica MgCl2.X H2O a 100°C perde todas as moléculas de água, formando um sólido branco de massa 0,7125g. Sendo assim, é correto afirmar que o número de moléculas de água (X) presentes na fórmula genérica é
(Dados: massas molares (g/mol): Mg = 24; Cl = 35,5; H = 1; O = 16)
(Dados: massas molares (g/mol): Mg = 24; Cl = 35,5; H = 1; O = 16)
Provas
Questão presente nas seguintes provas
Cadernos
Caderno Container