Foram encontradas 175 questões.
Diversos processos industriais, tais como o de produção de amônia, o de fabricação de metanol, o Fisher-Tropsch e o OXO, usam uma mistura de monóxido de carbono e hidrogênio largamente conhecida como gás de síntese. Uma das rotas de obtenção do gás de síntese é pela reforma do gás natural (mistura de hidrocarbonetos saturados leves, essencialmente metano, e compostos de enxofre, principalmente H2S) com vapor de água em regime contínuo. Nesse processo, que opera a pressão constante e de forma contínua, em regime permanente, conforme ilustrado na figura abaixo, o gás natural (que, para simplificar, será aqui considerado uma mistura de apenas metano e H2S) passa inicialmente em um reator contendo um leito fixo de óxido de zinco aquecido (reator de dessulfurização), onde o composto de enxofre é completamente eliminado da corrente, ocorrendo a retenção do enxofre no leito. O metano entra e sai desse reator a uma temperatura de 400 ºC, que é idêntica àquela do leito de catalisador. Cada mol de metano !$ (\overline{M}=16\,g\cdot mol^{-1}) !$, completamente dessulfurizado, é misturado com 3,5 mols de vapor de água !$ (\overline{M}=18\,g\cdot mol^{-1}) !$, e essa nova mistura é aquecida até 800 ºC. Então, essa mistura passa em um reator contendo um leito fixo de Ni suportado (reator de reforma), o qual é mantido a uma temperatura constante de 800 ºC, em que o monóxido de carbono é formado com 90% de rendimento, com uma variação de entalpia de !$ \Delta H=+52\,kcal \cdot mol^{-1}) !$. Na saída desse reator, tem-se uma mistura gasosa, a uma temperatura de 800 ºC, composta pelo monóxido de carbono !$ (\overline{M}=28 \,g\cdot mol^{-1}) !$ e gás hidrogênio !$ (\overline{M}=2 \,g\cdot mol^{-1}) !$ produzidos e pelo metano e vapor de água residuais.
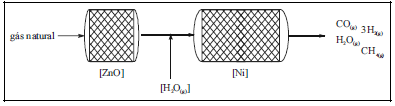
Com base no texto e na figura acima, que mostra o diagrama do processo de produção de gás de síntese, julgue o item a seguir, relativos ao processo de obtenção de gás de síntese.
O fluxo de massa, em !$ kg \cdot s^{-1} !$, que sai do reator de dessulfurização é menor que o fluxo de massa que entra nesse reator.
Provas
Questão presente nas seguintes provas
No processo de refino de petróleo, além de combustíveis, diversos produtos podem ser obtidos. Por exemplo, dos óleos pesados oriundos dos processos de destilação a pressão reduzida, podem ser extraídas as parafinas. Nesse processo, um solvente — mistura de tolueno e acetona — passa corrente em contracorrente em relação ao óleo pesado em uma torre de extração líquido-líquido. Na saída dessa torre, se obtém uma fase rica em solvente, a qual contém a parafina, e outra rica em óleo com baixo ponto de fluidez, que poderá dar origem a um óleo lubrificante. A fase rica em solvente é então resfriada, ocorrendo a precipitação da parafina, que é finalmente separada por filtração. Com relação a esse assunto, julgue o item seguinte.
O tipo de recheio a ser usado na torre de extração pode ser confeccionado com diferentes materiais, sendo sempre recomendáveis materiais de baixo custo, baixa densidade e quimicamente inertes.
Provas
Questão presente nas seguintes provas
O petróleo é matéria-prima para geração de muitos produtos da indústria química. Tais produtos são produzidos por meio de processos químicos projetados em escala industrial. Um dos equipamentos industriais mais utilizados são os reatores químicos de diversas formas e tamanhos.
Com base no texto acima, julgue o item a seguir, acerca de reatores químicos e reações químicas em processos industriais.
Projetos com reatores tubulares em série permitem empregar um volume total menor que projetos com um único reator tubular, para uma mesma taxa de conversão e alimentação.
Provas
Questão presente nas seguintes provas
O petróleo é matéria-prima para geração de muitos produtos da indústria química. Tais produtos são produzidos por meio de processos químicos projetados em escala industrial. Um dos equipamentos industriais mais utilizados são os reatores químicos de diversas formas e tamanhos.
Com base no texto acima, julgue o item a seguir, acerca de reatores químicos e reações químicas em processos industriais.
O tempo espacial em um reator de fluxo contínuo é expresso em função do volume do reator e da sua vazão de alimentação, sendo equivalente ao tempo de permanência, no caso especial de fluido com densidade constante.
Provas
Questão presente nas seguintes provas
Diversos processos industriais, tais como o de produção de amônia, o de fabricação de metanol, o Fisher-Tropsch e o OXO, usam uma mistura de monóxido de carbono e hidrogênio largamente conhecida como gás de síntese. Uma das rotas de obtenção do gás de síntese é pela reforma do gás natural (mistura de hidrocarbonetos saturados leves, essencialmente metano, e compostos de enxofre, principalmente H2S) com vapor de água em regime contínuo. Nesse processo, que opera a pressão constante e de forma contínua, em regime permanente, conforme ilustrado na figura abaixo, o gás natural (que, para simplificar, será aqui considerado uma mistura de apenas metano e H2S) passa inicialmente em um reator contendo um leito fixo de óxido de zinco aquecido (reator de dessulfurização), onde o composto de enxofre é completamente eliminado da corrente, ocorrendo a retenção do enxofre no leito. O metano entra e sai desse reator a uma temperatura de 400 ºC, que é idêntica àquela do leito de catalisador. Cada mol de metano !$ (\overline{M}=16\,g\cdot mol^{-1}) !$, completamente dessulfurizado, é misturado com 3,5 mols de vapor de água !$ (\overline{M}=18\,g\cdot mol^{-1}) !$, e essa nova mistura é aquecida até 800 ºC. Então, essa mistura passa em um reator contendo um leito fixo de Ni suportado (reator de reforma), o qual é mantido a uma temperatura constante de 800 ºC, em que o monóxido de carbono é formado com 90% de rendimento, com uma variação de entalpia de !$ \Delta H=+52\,kcal \cdot mol^{-1}) !$. Na saída desse reator, tem-se uma mistura gasosa, a uma temperatura de 800 ºC, composta pelo monóxido de carbono !$ (\overline{M}=28 \,g\cdot mol^{-1}) !$ e gás hidrogênio !$ (\overline{M}=2 \,g\cdot mol^{-1}) !$ produzidos e pelo metano e vapor de água residuais.

Com base no texto e na figura acima, que mostra o diagrama do processo de produção de gás de síntese, julgue o item a seguir, relativos ao processo de obtenção de gás de síntese.
Como o número de mols da mistura que deixa o reator é maior que o que entra, a densidade da mistura que sai desse reator é maior que a que entra.
Provas
Questão presente nas seguintes provas
No processo de fabricação de soda cáustica, uma solução aquosa de cloreto de sódio !$ (\overline{M}=58,5\, g \cdot mol^{-1}) !$, com concentração próxima a 30% em massa e densidade aproximadamente de 1,2 !$ g \cdot mol^{-1} !$, é eletrolisada a 60 ºC, produzindo hidróxido de sódio, gás hidrogênio e gás cloro. Entre outros procedimentos, a salmoura pode ser obtida conforme o processo ilustrado na figura seguinte, que opera a pressão constante e de forma contínua em regime permanente. Água !$ (\overline{M}=18\, g \cdot mol^{-1}) !$ a temperatura ambiente (25 ºC) é bombeada de um reservatório até um tanque agitado. Nesse tanque, é adicionado o cloreto de sódio, sendo a mistura homogeneizada com um agitador mecânico e aquecida com um fluido quente, que passa por uma camisa externa do tanque, até atingir a temperatura de 60 ºC.
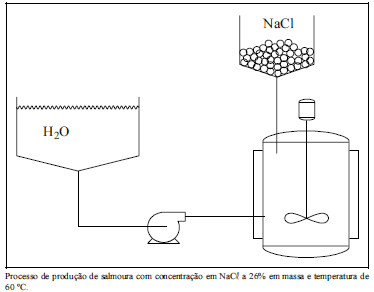
Julgue o item a seguir, relativos ao processo de obtenção de salmoura para a produção de soda cáustica, conforme descrito no texto e ilustrado na figura acima.
Considerando-se o tanque agitado como volume de controle, o balanço de massa pode ser definido como sendo a diferença entre a massa que sai do sistema (salmoura) e a massa que entra (a massa de água e a massa de sal), a qual será igual a zero.
Provas
Questão presente nas seguintes provas
Diversos processos industriais, tais como o de produção de amônia, o de fabricação de metanol, o Fisher-Tropsch e o OXO, usam uma mistura de monóxido de carbono e hidrogênio largamente conhecida como gás de síntese. Uma das rotas de obtenção do gás de síntese é pela reforma do gás natural (mistura de hidrocarbonetos saturados leves, essencialmente metano, e compostos de enxofre, principalmente H2S) com vapor de água em regime contínuo. Nesse processo, que opera a pressão constante e de forma contínua, em regime permanente, conforme ilustrado na figura abaixo, o gás natural (que, para simplificar, será aqui considerado uma mistura de apenas metano e H2S) passa inicialmente em um reator contendo um leito fixo de óxido de zinco aquecido (reator de dessulfurização), onde o composto de enxofre é completamente eliminado da corrente, ocorrendo a retenção do enxofre no leito. O metano entra e sai desse reator a uma temperatura de 400 ºC, que é idêntica àquela do leito de catalisador. Cada mol de metano !$ (\overline{M}=16\,g\cdot mol^{-1}) !$, completamente dessulfurizado, é misturado com 3,5 mols de vapor de água !$ (\overline{M}=18\,g\cdot mol^{-1}) !$, e essa nova mistura é aquecida até 800 ºC. Então, essa mistura passa em um reator contendo um leito fixo de Ni suportado (reator de reforma), o qual é mantido a uma temperatura constante de 800 ºC, em que o monóxido de carbono é formado com 90% de rendimento, com uma variação de entalpia de !$ \Delta H=+52\,kcal \cdot mol^{-1}) !$. Na saída desse reator, tem-se uma mistura gasosa, a uma temperatura de 800 ºC, composta pelo monóxido de carbono !$ (\overline{M}=28 \,g\cdot mol^{-1}) !$ e gás hidrogênio !$ (\overline{M}=2 \,g\cdot mol^{-1}) !$ produzidos e pelo metano e vapor de água residuais.

Com base no texto e na figura acima, que mostra o diagrama do processo de produção de gás de síntese, julgue o item a seguir, relativos ao processo de obtenção de gás de síntese.
O balanço total de massa do reator de reforma pode ser calculado, exatamente, como sendo a diferença entre as massas que saem do processo (soma das massas de 0,1 mol de metano; 0,9 mols de CO; 2,7 mols de H2; e 2,6 mols de água) e as que entram no reator (massa de 1 mol de metano e massa de 3,5 mols de água), a qual será igual a zero.
Provas
Questão presente nas seguintes provas
No processo de fabricação de soda cáustica, uma solução aquosa de cloreto de sódio !$ (\overline{M}=58,5\, g \cdot mol^{-1}) !$, com concentração próxima a 30% em massa e densidade aproximadamente de 1,2 !$ g \cdot mol^{-1} !$, é eletrolisada a 60 ºC, produzindo hidróxido de sódio, gás hidrogênio e gás cloro. Entre outros procedimentos, a salmoura pode ser obtida conforme o processo ilustrado na figura seguinte, que opera a pressão constante e de forma contínua em regime permanente. Água !$ (\overline{M}=18\, g \cdot mol^{-1}) !$ a temperatura ambiente (25 ºC) é bombeada de um reservatório até um tanque agitado. Nesse tanque, é adicionado o cloreto de sódio, sendo a mistura homogeneizada com um agitador mecânico e aquecida com um fluido quente, que passa por uma camisa externa do tanque, até atingir a temperatura de 60 ºC.

Julgue o item a seguir, relativos ao processo de obtenção de salmoura para a produção de soda cáustica, conforme descrito no texto e ilustrado na figura acima.
Como existe adição de sal, a massa específica do fluido se altera ao longo do processo. Caso houvesse apenas o aquecimento da salmoura no tanque, ou seja, caso a adição do sal ocorresse antes da entrada, a massa específica iria permanecer constante ao longo do sistema.
Provas
Questão presente nas seguintes provas
O programa PROÁLCOOL foi criado no Brasil em 1975, como uma alternativa energética ao petróleo. Nele, o álcool etílico era usado como aditivo à gasolina (álcool anidro) ou diretamente como combustível (álcool hidratado). Esse programa aumentou muito o interesse pelo processo de obtenção desse produto, devido à possibilidade de independência energética para o país. A produção de álcool nas usinas utiliza como matéria-prima uma solução de açúcar, conhecida por melaço, obtida a partir da canade- açúcar. Nesse processo, faz-se uma diluição do melaço até atingir uma concentração em açúcar inferior a 17%, passando a ser chamado de mosto. Este é fermentado com leveduras, dando origem ao vinho fermentado, que possui uma concentração em álcool de aproximadamente 10%. O vinho obtido é então destilado, em torres de pratos ou recheadas, sendo o álcool purificado até atingir concentrações que variam de 92% (álcool hidratado) a 99,3% (álcool anidro), conforme o produto desejado. Nesse processo, o vinho pode ser considerado como sendo uma mistura binária de álcool e água. A figura acima representa o diagrama de equilíbrio de fases da mistura binária álcool/água. Nota-se que esta é uma mistura azeotrópica, sendo a composição em álcool no ponto de azeótropo (c3) de aproximadamente 95,6 %.
Julgue o item a seguir, relativos ao processo de destilação da mistura binária água/álcool, descrito no texto acima.
A partir de um vinho fermentado, pode-se obter, por destilação fracionada, álcool anidro, sendo necessário apenas determinar o número de pratos teóricos adequado.
Provas
Questão presente nas seguintes provas
Diversos processos industriais, tais como o de produção de amônia, o de fabricação de metanol, o Fisher-Tropsch e o OXO, usam uma mistura de monóxido de carbono e hidrogênio largamente conhecida como gás de síntese. Uma das rotas de obtenção do gás de síntese é pela reforma do gás natural (mistura de hidrocarbonetos saturados leves, essencialmente metano, e compostos de enxofre, principalmente H2S) com vapor de água em regime contínuo. Nesse processo, que opera a pressão constante e de forma contínua, em regime permanente, conforme ilustrado na figura abaixo, o gás natural (que, para simplificar, será aqui considerado uma mistura de apenas metano e H2S) passa inicialmente em um reator contendo um leito fixo de óxido de zinco aquecido (reator de dessulfurização), onde o composto de enxofre é completamente eliminado da corrente, ocorrendo a retenção do enxofre no leito. O metano entra e sai desse reator a uma temperatura de 400 ºC, que é idêntica àquela do leito de catalisador. Cada mol de metano !$ (\overline{M}=16\,g\cdot mol^{-1}) !$, completamente dessulfurizado, é misturado com 3,5 mols de vapor de água !$ (\overline{M}=18\,g\cdot mol^{-1}) !$, e essa nova mistura é aquecida até 800 ºC. Então, essa mistura passa em um reator contendo um leito fixo de Ni suportado (reator de reform
Provas
Questão presente nas seguintes provas
Cadernos
Caderno Container