Foram encontradas 40 questões.
Observe o esquema abaixo, que representa o mecanismo de hidrólise de um peptídeo pela HIV protease, classificada como uma aspartato protease.

A partir da análise dessa proposta mecanística, analise as afirmações a seguir.
Os dois resíduos de ácido aspártico presentes no centro ativo da HIV protease são essenciais para a sua atividade catalítica.
PORQUE
eles interagem através de ligações hidrogênio com uma molécula de água, aumentando a nucleofilicidade da mesma e favorecendo o ataque nucleofílico à ligação peptídica do substrato.
A esse respeito, conclui-se que
Provas
Questão presente nas seguintes provas
Os ciclos biogeoquímicos do carbono e do nitrogênio são fundamentais para a manutenção da vida na Terra, dependendo de um intrincado processo envolvendo diversas biotransformações. A esse respeito, relacione os processos apresentados na coluna da esquerda com as reações de biotransformação que se encontram na coluna da direita.
Nome do processo
I – Amonificação
II – Desnitrificação
III – Fotossíntese
IV – Respiração
Reação de biotransformação
P – Redução de N2 a NH3
Q – Redução de NO2 a N2
R – Redução de CO2 a carboidratos
S – Oxidação de carboidratos a CO2
T – Redução de N2 a ureia
Estão corretas as associações
Provas
Questão presente nas seguintes provas
Observe o gráfico abaixo.
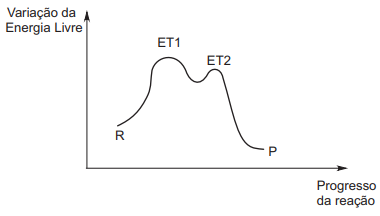
Com base no gráfico, analise as afirmativas a seguir.
I - A reação descrita tem dois estados de transição (ET1 e ET2), sendo que o primeiro será aquele que controlará a velocidade da reação, por ser o de mais alta energia.
II - A velocidade de reação será controlada apenas pela concentração dos reagentes (R) que participam da formação do estado de transição ET1, por ser este o de maior energia.
III - A velocidade de formação do produto P será inversamente proporcional à de formação do intermediário I, já que este é consumido durante a formação de P.
É(São) correta(s) APENAS a(s) afirmativa(s)
Provas
Questão presente nas seguintes provas
Foram detectados, em diversos rios e sistemas hídricos, altos teores de alumínio na água potável, muito acima do limite permitido pela ANVISA, que é da ordem de 0,004 mmol/L. Existe ainda o risco de contaminação com bário, um metal de alta toxicidade (limite máximo de 0,7 mg/L). A partir de análises químicas dos teores de alumínio e bário em três desses sistemas hídricos, os dados abaixo foram obtidos.

Com base nos dados acima, e sabendo-se que as massas atômicas do alumínio e do bário são, respectivamente, 27 e 137 u.m.a., conclui-se que os consumidores do(s)
Provas
Questão presente nas seguintes provas
O SO3 é um dos principais poluentes atmosféricos, sendo responsável pela destruição de florestas em diversas regiões do mundo. Sua principal fonte é a queima de compostos sulfurados presentes em diversos materiais oriundos da indústria petroquímica. Sobre este processo, analise as afirmações que se seguem.
I – O enxofre é oxidado na combustão a dióxido de enxofre que, por sua vez, sofre oxidação, gerando SO3 .
II – O SO3 sofre reação de hidratação, levando à formação de H2 SO4 , que é o único ácido responsável pelo fenômeno chamado chuva ácida.
III – Devido à baixa reatividade do SO3 frente à água, o H2 SO4 só é formado em nuvens de tempestades associadas a relâmpagos.
É(São) verdadeira(s) a(s) afirmação(ões)
Provas
Questão presente nas seguintes provas
Alguns livros de Química destinados ao Ensino Básico propõem, no capítulo referente a ligações químicas, um experimento envolvendo o aquecimento, em uma chama, de uma pequena quantidade de cloreto de sódio e de parafina (mistura de hidrocarbonetos sólidos). Uma conclusão comumente associada a este experimento é a de que as ligações iônicas são mais fortes que as ligações covalentes, já que a parafina sofre fusão, enquanto que o cloreto de sódio permanece sólido. Esta conclusão está
Provas
Questão presente nas seguintes provas
!$ 2 NO (g) \rightleftharpoons N_2 (g) + O_2 (g) !$
A constante de equilíbrio para a reação acima é igual a 4,3 x 108 a 200 o C. Com base neste dado, considere as afirmações que se seguem.
I – O sistema em questão é composto por três compostos diferentes, sendo que, no equilíbrio, o componente presente em menor concentração é o óxido nítrico.
II – O valor da constante de equilíbrio demonstra que a velocidade de formação de NO é 4,3 x 108 vezes mais lenta que a sua velocidade de decomposição.
III – Após o total consumo do NO, formando N2 e O2 , a reação se reverte, regenerando NO em uma velocidade 4,3 x 108 menor que a sua decomposição.
Está(ão) correta(s) APENAS a(s) afirmação(ões)
Provas
Questão presente nas seguintes provas
O valor de H (variação de entalpia) para a fusão da água é positivo (+ 6 kJ/mol) e, ao mesmo tempo, é um processo espontâneo. Sabendo-se que a variação de energia livre de Gibbs (!$ Δ !$G) pode ser calculada pela expressão !$ Δ !$G = !$ Δ !$H - T!$ Δ !$S, onde T é temperatura e S, a variação de entropia do sistema, conclui-se que a fusão é um processo espontâneo,
Provas
Questão presente nas seguintes provas
O ferro é um dos elementos mais abundantes da crosta terrestre, e sua distribuição eletrônica pode ser descrita como [Ar] 3d6 4s2 . Entretanto, este elemento ocorre mais frequentemente na forma de dois íons: o Fe2+ e o Fe3+. As estruturas eletrônicas destes dois íons são descritas, respectivamente, como:
Provas
Questão presente nas seguintes provas
Observe os valores de pKa para os ácidos conjugados dos compostos abaixo.

A partir destes dados, conclui-se que a
Provas
Questão presente nas seguintes provas
Cadernos
Caderno Container