Foram encontradas 355 questões.
Dois dos obstáculos para a disseminação do emprego das células a combustível são: a obtenção do H2 de forma sustentável e a dificuldade de armazenamento do H2 (g), visto que pressões muito elevadas do gás são necessárias para a obtenção de densidades energéticas consideradas viáveis para a aplicação veicular. Tradicionalmente, a maioria do H2 empregado no mundo é produzida pela reforma do metano de origem fóssil, processo que resulta em intensa geração de CO2. Por esse motivo, tem-se buscado otimizar a produção do denominado hidrogênio verde, obtido por meio da eletrólise da água, utilizando-se energia elétrica gerada de maneira sustentável (por exemplo, a partir de placas de energia solar). No processo, uma corrente elétrica é aplicada a uma solução aquosa (usualmente uma solução de NaOH), de forma que as semirreações representadas a seguir ocorrem nos eletrodos.
catodo: 2 H3O+ + 2 e– → H2 + 2 H2O
anodo: 2 OH− → H2O + ½ O2 + 2 e–
Tendo como referência o texto precedente, sabendo que a constante universal dos gases vale 0,082 atm!$ \cdot !$L!$ \cdot !$mol-1!$ \cdot !$K-1, a constante de Faraday, 96.500 C!$ \cdot !$mol-1, a constante de autoprotólise da água, 1,0 !$ \times !$ 10-14, e assumindo que todos os gases e soluções envolvidos se comportem idealmente, julgue o item que se segue.
Para a geração de 36 mg de H2 por hora a partir da eletrólise da água, a corrente elétrica média necessária deverá ser superior a 0,80 A.
Provas
Dois dos obstáculos para a disseminação do emprego das células a combustível são: a obtenção do H2 de forma sustentável e a dificuldade de armazenamento do H2 (g), visto que pressões muito elevadas do gás são necessárias para a obtenção de densidades energéticas consideradas viáveis para a aplicação veicular. Tradicionalmente, a maioria do H2 empregado no mundo é produzida pela reforma do metano de origem fóssil, processo que resulta em intensa geração de CO2. Por esse motivo, tem-se buscado otimizar a produção do denominado hidrogênio verde, obtido por meio da eletrólise da água, utilizando-se energia elétrica gerada de maneira sustentável (por exemplo, a partir de placas de energia solar). No processo, uma corrente elétrica é aplicada a uma solução aquosa (usualmente uma solução de NaOH), de forma que as semirreações representadas a seguir ocorrem nos eletrodos.
catodo: 2 H3O+ + 2 e– → H2 + 2 H2O
anodo: 2 OH− → H2O + ½ O2 + 2 e–
Tendo como referência o texto precedente, sabendo que a constante universal dos gases vale 0,082 atm!$ \cdot !$L!$ \cdot !$mol-1!$ \cdot !$K-1, a constante de Faraday, 96.500 C!$ \cdot !$mol-1, a constante de autoprotólise da água, 1,0 !$ \times !$ 10-14, e assumindo que todos os gases e soluções envolvidos se comportem idealmente, julgue o item que se segue.
Considere-se que um automóvel movido a H2 (g) possua um reservatório com capacidade para 100 L do gás e apresente um consumo médio de 1,0 kg de H2 a cada 100 km percorridos. Considere-se, também, que, no momento do abastecimento com o gás, o reservatório esteja na temperatura de 300 K. Nessas condições, para que o automóvel possa percorrer 600 km sem necessitar de novo abastecimento, o gás deverá estar armazenado a uma pressão superior a 600 atm.
Provas
Dois dos obstáculos para a disseminação do emprego das células a combustível são: a obtenção do H2 de forma sustentável e a dificuldade de armazenamento do H2 (g), visto que pressões muito elevadas do gás são necessárias para a obtenção de densidades energéticas consideradas viáveis para a aplicação veicular. Tradicionalmente, a maioria do H2 empregado no mundo é produzida pela reforma do metano de origem fóssil, processo que resulta em intensa geração de CO2. Por esse motivo, tem-se buscado otimizar a produção do denominado hidrogênio verde, obtido por meio da eletrólise da água, utilizando-se energia elétrica gerada de maneira sustentável (por exemplo, a partir de placas de energia solar). No processo, uma corrente elétrica é aplicada a uma solução aquosa (usualmente uma solução de NaOH), de forma que as semirreações representadas a seguir ocorrem nos eletrodos.
catodo: 2 H3O+ + 2 e– → H2 + 2 H2O
anodo: 2 OH− → H2O + ½ O2 + 2 e–
Tendo como referência o texto precedente, sabendo que a constante universal dos gases vale 0,082 atm!$ \cdot !$L!$ \cdot !$mol-1!$ \cdot !$K-1, a constante de Faraday, 96.500 C!$ \cdot !$mol-1, a constante de autoprotólise da água, 1,0 !$ \times !$ 10-14, e assumindo que todos os gases e soluções envolvidos se comportem idealmente, julgue o item que se segue.
Uma solução de NaOH apresenta pressão de vapor superior à da água pura na mesma temperatura.
Provas
Dois dos obstáculos para a disseminação do emprego das células a combustível são: a obtenção do H2 de forma sustentável e a dificuldade de armazenamento do H2 (g), visto que pressões muito elevadas do gás são necessárias para a obtenção de densidades energéticas consideradas viáveis para a aplicação veicular. Tradicionalmente, a maioria do H2 empregado no mundo é produzida pela reforma do metano de origem fóssil, processo que resulta em intensa geração de CO2. Por esse motivo, tem-se buscado otimizar a produção do denominado hidrogênio verde, obtido por meio da eletrólise da água, utilizando-se energia elétrica gerada de maneira sustentável (por exemplo, a partir de placas de energia solar). No processo, uma corrente elétrica é aplicada a uma solução aquosa (usualmente uma solução de NaOH), de forma que as semirreações representadas a seguir ocorrem nos eletrodos.
catodo: 2 H3O+ + 2 e– → H2 + 2 H2O
anodo: 2 OH− → H2O + ½ O2 + 2 e–
Tendo como referência o texto precedente, sabendo que a constante universal dos gases vale 0,082 atm!$ \cdot !$L!$ \cdot !$mol-1!$ \cdot !$K-1, a constante de Faraday, 96.500 C!$ \cdot !$mol-1, a constante de autoprotólise da água, 1,0 !$ \times !$ 10-14, e assumindo que todos os gases e soluções envolvidos se comportem idealmente, julgue o item que se segue.
Se a concentração de uma solução de NaOH for de 0,10 mol/L, então o pH dessa solução será superior a 10.
Provas
Em 1839, Sir William Grove inventou a primeira célula a combustível. Ele sabia que, ao passar uma corrente elétrica através da água, ela poderia ser dividida em hidrogênio e oxigênio (um processo chamado eletrólise). Ele levantou a hipótese de que, invertendo-se o procedimento, seria possível produzir eletricidade e água. Ele criou uma célula a combustível primitiva e a chamou de bateria voltaica a gás. Depois de experimentar sua nova invenção, Grove comprovou sua hipótese. Cinquenta anos depois, os cientistas Ludwig Mond e Charles Langer cunharam o termo “célula a combustível” enquanto tentavam construir um modelo prático para produzir eletricidade.
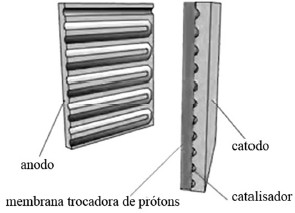
Internet: <auto.howstuffworks.com> (com adaptações).
Células a combustível são excelentes para a utilização do hidrogênio como alternativa aos combustíveis fósseis, considerados “vilões” do aquecimento global. Elas funcionam da seguinte forma: o anodo, o polo negativo da célula, conduz os elétrons liberados das moléculas de hidrogênio para um circuito elétrico. O catodo, o polo positivo da célula, possui canais nele gravados que distribuem o oxigênio para a superfície do catalisador. O catodo também conduz os elétrons do circuito elétrico para o catalisador, onde eles se unem aos íons hidrogênio e ao oxigênio para formar água.
Tendo o texto precedente como referência inicial, julgue o item abaixo.
Na célula a combustível, a função do catalisador é reagir com os íons hidrogênio, com a molécula de oxigênio e com os elétrons recebidos do anodo para gerar energia.
Provas
Em 1839, Sir William Grove inventou a primeira célula a combustível. Ele sabia que, ao passar uma corrente elétrica através da água, ela poderia ser dividida em hidrogênio e oxigênio (um processo chamado eletrólise). Ele levantou a hipótese de que, invertendo-se o procedimento, seria possível produzir eletricidade e água. Ele criou uma célula a combustível primitiva e a chamou de bateria voltaica a gás. Depois de experimentar sua nova invenção, Grove comprovou sua hipótese. Cinquenta anos depois, os cientistas Ludwig Mond e Charles Langer cunharam o termo “célula a combustível” enquanto tentavam construir um modelo prático para produzir eletricidade.

Internet: <auto.howstuffworks.com> (com adaptações).
Células a combustível são excelentes para a utilização do hidrogênio como alternativa aos combustíveis fósseis, considerados “vilões” do aquecimento global. Elas funcionam da seguinte forma: o anodo, o polo negativo da célula, conduz os elétrons liberados das moléculas de hidrogênio para um circuito elétrico. O catodo, o polo positivo da célula, possui canais nele gravados que distribuem o oxigênio para a superfície do catalisador. O catodo também conduz os elétrons do circuito elétrico para o catalisador, onde eles se unem aos íons hidrogênio e ao oxigênio para formar água.
Tendo o texto precedente como referência inicial, julgue o item abaixo.
A reação eletroquímica que ocorre em uma célula a combustível produz CO2 e H2O.
Provas
Em 1839, Sir William Grove inventou a primeira célula a combustível. Ele sabia que, ao passar uma corrente elétrica através da água, ela poderia ser dividida em hidrogênio e oxigênio (um processo chamado eletrólise). Ele levantou a hipótese de que, invertendo-se o procedimento, seria possível produzir eletricidade e água. Ele criou uma célula a combustível primitiva e a chamou de bateria voltaica a gás. Depois de experimentar sua nova invenção, Grove comprovou sua hipótese. Cinquenta anos depois, os cientistas Ludwig Mond e Charles Langer cunharam o termo “célula a combustível” enquanto tentavam construir um modelo prático para produzir eletricidade.

Internet: <auto.howstuffworks.com> (com adaptações).
Células a combustível são excelentes para a utilização do hidrogênio como alternativa aos combustíveis fósseis, considerados “vilões” do aquecimento global. Elas funcionam da seguinte forma: o anodo, o polo negativo da célula, conduz os elétrons liberados das moléculas de hidrogênio para um circuito elétrico. O catodo, o polo positivo da célula, possui canais nele gravados que distribuem o oxigênio para a superfície do catalisador. O catodo também conduz os elétrons do circuito elétrico para o catalisador, onde eles se unem aos íons hidrogênio e ao oxigênio para formar água.
Tendo o texto precedente como referência inicial, julgue o item abaixo.
Na reação que ocorre na célula a combustível, o hidrogênio é o agente oxidante e o oxigênio, o agente redutor.
Provas
Em 1839, Sir William Grove inventou a primeira célula a combustível. Ele sabia que, ao passar uma corrente elétrica através da água, ela poderia ser dividida em hidrogênio e oxigênio (um processo chamado eletrólise). Ele levantou a hipótese de que, invertendo-se o procedimento, seria possível produzir eletricidade e água. Ele criou uma célula a combustível primitiva e a chamou de bateria voltaica a gás. Depois de experimentar sua nova invenção, Grove comprovou sua hipótese. Cinquenta anos depois, os cientistas Ludwig Mond e Charles Langer cunharam o termo “célula a combustível” enquanto tentavam construir um modelo prático para produzir eletricidade.

Internet: <auto.howstuffworks.com> (com adaptações).
Células a combustível são excelentes para a utilização do hidrogênio como alternativa aos combustíveis fósseis, considerados “vilões” do aquecimento global. Elas funcionam da seguinte forma: o anodo, o polo negativo da célula, conduz os elétrons liberados das moléculas de hidrogênio para um circuito elétrico. O catodo, o polo positivo da célula, possui canais nele gravados que distribuem o oxigênio para a superfície do catalisador. O catodo também conduz os elétrons do circuito elétrico para o catalisador, onde eles se unem aos íons hidrogênio e ao oxigênio para formar água.
Tendo o texto precedente como referência inicial, julgue o item abaixo.
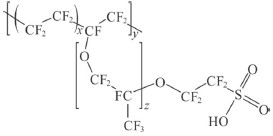
Considerando-se que a membrana trocadora de prótons, mencionada no texto, seja formada pelo material cuja fórmula estrutural é mostrada a seguir, então, nesse caso, tal material pode ser corretamente caracterizado como um copolímero.
Provas
Em 1839, Sir William Grove inventou a primeira célula a combustível. Ele sabia que, ao passar uma corrente elétrica através da água, ela poderia ser dividida em hidrogênio e oxigênio (um processo chamado eletrólise). Ele levantou a hipótese de que, invertendo-se o procedimento, seria possível produzir eletricidade e água. Ele criou uma célula a combustível primitiva e a chamou de bateria voltaica a gás. Depois de experimentar sua nova invenção, Grove comprovou sua hipótese. Cinquenta anos depois, os cientistas Ludwig Mond e Charles Langer cunharam o termo “célula a combustível” enquanto tentavam construir um modelo prático para produzir eletricidade.

Internet: <auto.howstuffworks.com> (com adaptações).
Células a combustível são excelentes para a utilização do hidrogênio como alternativa aos combustíveis fósseis, considerados “vilões” do aquecimento global. Elas funcionam da seguinte forma: o anodo, o polo negativo da célula, conduz os elétrons liberados das moléculas de hidrogênio para um circuito elétrico. O catodo, o polo positivo da célula, possui canais nele gravados que distribuem o oxigênio para a superfície do catalisador. O catodo também conduz os elétrons do circuito elétrico para o catalisador, onde eles se unem aos íons hidrogênio e ao oxigênio para formar água.
Tendo o texto precedente como referência inicial, julgue o item abaixo.
As semirreações que ocorrem no anodo e no catodo são apresentadas a seguir, conforme as informações do texto.
anodo: 2 H2 → 4 H+ + 4 e−
catodo: O2 + 4 H+ + 4 e− → 2 H2O
Provas
Uma das formas de se prevenir o aquecimento global é a utilização de fontes energéticas obtidas a partir da biomassa. Embora os combustíveis renováveis obtidos da biomassa emitam CO2 na atmosfera assim como os combustíveis fósseis, a produção de biomassa “sequestra” esse CO2 de volta, pois essa molécula é utilizada pelas plantas no processo de fotossíntese. A fotossíntese produz moléculas orgânicas complexas, como glicose, celulose, amido, aminoácidos, proteínas, entre outros constituintes dos vegetais, na presença de clorofila e luz solar. A reação genérica da fotossíntese é representada a seguir, em que (CH2O)n representa um carboidrato genérico.
n CO2 + n H2O + luz solar → (CH2O)n + n O2
Durante a fotossíntese, os primeiros carboidratos produzidos são os açúcares de três carbonos, como o gliceraldeído, por exemplo, cuja fórmula estrutural é mostrada a seguir.
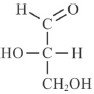
Internet: <pt.wikipedia.org/wiki/>.
Cerca de 33% da biomassa do planeta é formada por celulose, cuja fórmula estrutural é mostrada a seguir. A celulose é um polissacarídeo formado pela união de moléculas de !$ \beta !$-glicose, por meio de ligações !$ \beta !$-1,4-glicosídicas.
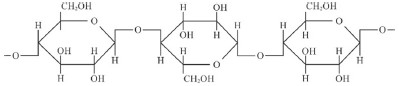
Internet: <pt.wikipedia.org/wiki/>.
Com base nas informações do texto antecedente, julgue o item abaixo.
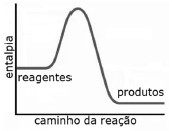
O gráfico a seguir representa corretamente a variação de entalpia da reação da fotossíntese ao longo da reação.
Provas
Caderno Container