Foram encontradas 50 questões.
A precisão e a exatidão das medidas de um método analítico são fundamentais para a garantia da qualidade dos resultados obtidos. Medidas inexatas em um laboratório podem acarretar erros de interpretação de um determinado fenômeno, perda de produção na indústria, tratamentos equivocados e desperdício de energia em diversos setores produtivos e na sociedade. Portanto, todo método analítico deve apresentar um grau minimanente aceitável de precisão e exatidão dos resultados. Para isso, análises comparativas entre métodos independentes e análises de materiais de referência certificados devem ser realizadas para determinação desses parâmetros a partir dos resultados experimentais.
A figura a seguir ilustra quatro situações hipotéticas que podem acontecer nos resultados de medição por um determinado método analítico.
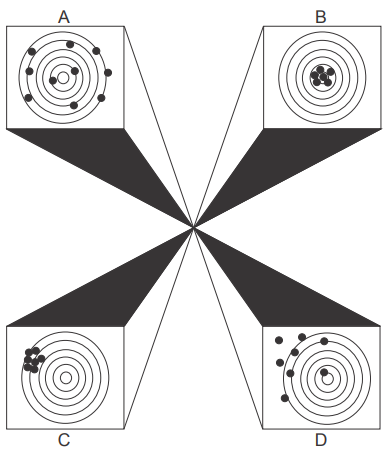
Fonte: Cienfuegos, Freddy. Estatística aplicada ao laboratório:
Rio de Janeiro: Interciência, 2005. p.7. (Adaptado)
Nesta figura, o centro do alvo simboliza o resultado esperado para as medidas repetidas em relação ao certificado de referência da amostra analisada. De acordo com essa definição, assinale V (verdadeiro) ou F (falso) em cada afirmativa a seguir.
( ) Na situação A os resultados são imprecisos.
( ) Na situação B os resultados são inexatos.
( ) Na situação C os resultados são precisos, mas inexatos.
( ) Na situação D os resultados são imprecisos, mas exatos.
A sequência correta é
Provas
- Química InorgânicaSoluções e Substâncias InorgânicasSoluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais
As figuras a seguir ilustram quatro curvas de titulação volumétrica de neutralização (A, B, C e D), envolvendo ácidos e bases de concentrações iguais.
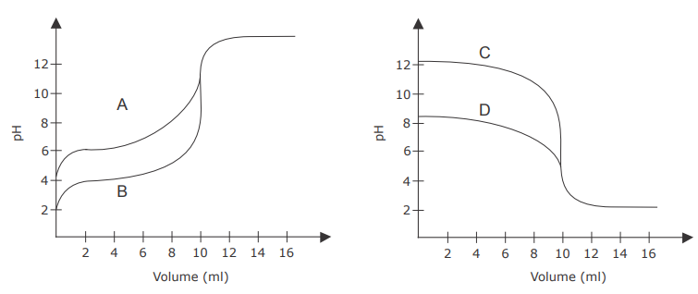
Em relação às curvas de titulação da figura, assinale V (verdadeiro) ou F (falso) em cada afirmativa a seguir.
( ) A curva "A" representa a titulação de um ácido fraco com uma base forte.
( ) A curva "B" representa a titulação de um ácido muito fraco com uma base forte.
( ) A curva "C" representa a titulação de uma base fraca com um ácido forte.
( ) A curva "D" representa a titulação de um ácido fraco com uma base forte.
A sequência correta é
Provas
- Química InorgânicaSoluções e Substâncias InorgânicasSoluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais
- Técnicas de LaboratórioEquipamentos e Técnicas Básicas
Para a determinação colorimétrica de um composto "X" na faixa de concentração de 1 a 8 mg/L, um analista realizou a medida de absorvância para 4 padrões em um colorímetro de bancada. A curva de calibração preparada pelo analista pode ser visualizada na figura.
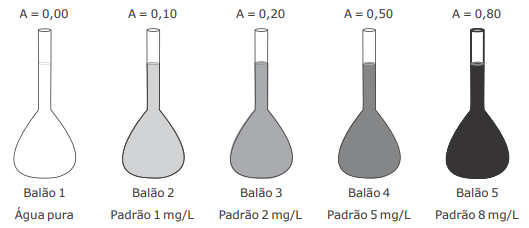
Sabendo que a análise do composto "X" deve apresentar absorvância no intervalo entre 0,10 e 0,80 e que o rótulo da amostra contendo o composto "X" indica uma concentração de 2000 mg/L, considere as afirmativas a seguir.
I - A amostra precisa ser diluída 100 vezes para que possa ser medida pelo método colorimétrico proposto no intervalo de concentração e absorvâncias mostrado na figura.
II - 1 mL da amostra deve ser pipetado em um balão volumétrico de 500 mL e o volume aferido com água desionizada, para que essa amostra possa ser medida pelo método colorimétrico proposto no intervalo de concentração e absorvâncias mostrado na figura.
III - 5 mL da amostra devem ser pipetados em um balão volumétrico de 500 mL e o volume aferido com água desionizada, para que essa amostra possa ser medida pelo método colorimétrico proposto no intervalo de concentração e absorvâncias mostrado na figura.
IV - 1 mL da amostra deve ser pipetado em um balão volumétrico de 250 mL e o volume aferido com água desionizada, para que essa amostra possa ser medida pelo método colorimétrico proposto no intervalo de concentração e absorvâncias mostrado na figura.
Está(ão) correta(s)
Provas
I - A absortividade molar de um composto aumenta com a sua concentração.
II - A absorvância e a absortividade molar do composto são inversamente proporcionais.
III - As dimensões do percurso ótico utilizado no colorímetro influenciam diretamente na quantidade de luz absorvida pelo composto.
IV - A absorvância medida para o composto de concentração "X" duplica, se a sua concentração passar para "4X" na medida colorimétrica com um percurso ótico de igual dimensão.
Está(ão) correta(s)
Provas
- Química InorgânicaSoluções e Substâncias InorgânicasSoluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais
SOLUÇÃO 1 - 10 mL da solução estoque (2,010 mol/L) foi pipetado e transferido para um balão volumétrico de 100 mL, onde o volume foi completado com água desionizada.
SOLUÇÃO 2 - 5 mL da SOLUÇÃO 1 foi pipetado e transferido para um balão volumétrico de 50 mL, onde o volume foi completado com água desionizada.
As concentrações finais da SOLUÇÃO 1 e SOLUÇÃO 2 são, respectivamente,
Provas
O cloreto de prata (AgCl) é um sal pouco solúvel em água pura, com um produto de solubilidade (Kps) igual a 1,8x10-10. Quando em contato com a água, apresenta uma baixa concentração de íons Ag+(1,34x10-5 mol/L) e íons Cl- (1,34x10-5 mol/L) no equilíbrio químico em solução devido à reação
AgCl(s) ⇄ Ag+ (aq) + Cl- (aq)
Em qual das soluções a seguir o sal AgCl será mais insolúvel, quando comparado com a água pura?
Provas
O quadro abaixo apresenta potenciais-padrão (E0) para semirreações de redução de cinco elementos.
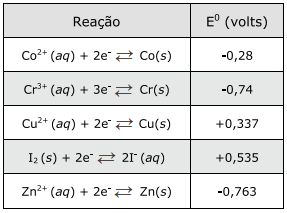
A ordem crescente de poder redutor conforme as reações de redução acima é
Provas
- Química InorgânicaSoluções e Substâncias Inorgânicas
- Sistemas de EquilíbrioSistemas Heterogêneos: Produto de Solubilidade (Kps)
Resíduos de metais pesados gerados em laboratório químico podem ser tratados por reação de precipitação com carbonato, geralmente na forma de calcário. O sólido obtido é filtrado em papel e armazenado, sendo que o líquido filtrado é neutralizado antes do descarte. Para a separação de resíduos dos íons metálicos Pb2+ , Cd2+ e Cu2+, a precipitação ocorre de acordo com as seguintes reações:

Em relação às reações de precipitação e seus produtos de solubilidade (Kps), considere as afirmativas a seguir.
I - Cu2+ é o íon mais insolúvel da mistura na precipitação com íon ![]()
II - Pb2+ é o íon mais solúvel da mistura na precipitação com íon ![]()
III - Cd2+ é mais insolúvel do que Cu2+ e Pb2+ na
precipitação com íon ![]()
Está(ão) correta(s)
Provas
Provas
O ácido fosfórico é um reagente amplamente utilizado nas indústrias alimentícias, têxtil e metalúrgica. Na fabricação de fertilizantes, o H3PO4 também é frequentemente empregado na produção de superfosfatos. Em laboratórios de análises químicas, o H3PO4 é frequentemente utilizado para o preparo de soluções aquosas destinadas à realização de um grande número de procedimentos. Esse ácido se dissocia em água de acordo com as seguintes reações de hidrólise:
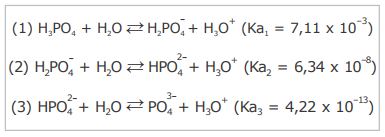
A partir das reações demonstradas acima, considere as seguintes afirmativas.
I - A partir da dissociação do H3PO4, três bases conjugadas são formadas na solução em equilíbrio químico.
II - A etapa (3) de dissociação libera a maior concentração de íons hidrônio (H3O+) na solução em equilíbrio químico.
III - A concentração do ânion ![]() é maior que a concentração do ânion
é maior que a concentração do ânion ![]() na solução em equilíbrio 4
químico.
na solução em equilíbrio 4
químico.
IV - A concentração do ânion ![]() é maior que a concentração do ânion
é maior que a concentração do ânion ![]() na solução em equilíbrio químico.
na solução em equilíbrio químico.
Estão corretas
Provas
Caderno Container