Foram encontradas 120 questões.
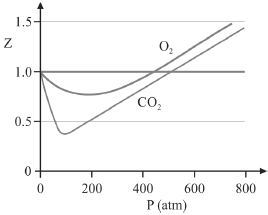
O O2 (g) produzido na decomposição de 4,00 mol de H2O2 foi coletado a uma pressão de 1,00 atm e uma temperatura de 300 K. Posteriormente, o gás foi comprimido adiabaticamente pelo deslocamento de um pistão móvel até que a pressão interna atingisse 300 atm. Imediatamente após a compressão, a temperatura verificada foi T2.
A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1, que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como:
!$ p = { \large R.T \over \overline{V} - b} - { \large \alpha \over \overline{V}^2} !$, julgue o item que se segue.
A partir do gráfico apresentado, conclui-se que o CO2 (g) apresenta a constante b na equação de van der Waals inferior à do O2 (g).
Provas
Questão presente nas seguintes provas

O O2 (g) produzido na decomposição de 4,00 mol de H2O2 foi coletado a uma pressão de 1,00 atm e uma temperatura de 300 K. Posteriormente, o gás foi comprimido adiabaticamente pelo deslocamento de um pistão móvel até que a pressão interna atingisse 300 atm. Imediatamente após a compressão, a temperatura verificada foi T2.
A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1, que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como:
!$ p = { \large R.T \over \overline{V} - b} - { \large \alpha \over \overline{V}^2} !$, julgue o item que se segue.
Quando atingida a pressão de 300 atm e a temperatura T2, o volume ocupado pelo gás será menor do que aquele que seria ocupado, nas mesmas condições, por um gás ideal.
Provas
Questão presente nas seguintes provas

O O2 (g) produzido na decomposição de 4,00 mol de H2O2 foi coletado a uma pressão de 1,00 atm e uma temperatura de 300 K. Posteriormente, o gás foi comprimido adiabaticamente pelo deslocamento de um pistão móvel até que a pressão interna atingisse 300 atm. Imediatamente após a compressão, a temperatura verificada foi T2.
A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1, que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como:
!$ p = { \large R.T \over \overline{V} - b} - { \large \alpha \over \overline{V}^2} !$, julgue o item que se segue.
A temperatura T2 é inferior àquela verificada imediatamente antes da compressão.
Provas
Questão presente nas seguintes provas

Na hemoglobina, um íon Fe2+ se encontra coordenado a quatro átomos de nitrogênio de um anel porfirínico e a mais um nitrogênio de um grupo histidina que faz parte da proteína. A sexta posição na geometria octaédrica pode ser preenchida por uma molécula de O2 para formar a oxiemoglobina, responsável pelo transporte do O2 pela corrente sanguínea. De acordo com a teoria do campo cristalino, a oxiemoglobina consiste em um complexo de spin baixo. Por outro lado, se a molécula de O2 é substituída por uma molécula de H2O, tem-se então um complexo de spin alto. A figura precedente mostra os níveis de energia para os orbitais d antes e após o desdobramento pelo campo cristalino em um complexo octaédrico.
Com base nas informações e na figura apresentadas e considerando que a configuração eletrônica do íon Fe2+ é d6, julgue o item, de acordo com a teoria do campo cristalino.
Na hemoglobina com uma molécula de H2O substituindo a molécula de O2, a energia de estabilização do campo cristalino é igual a -0,4 × Δoct, em que Δoct é o valor do desdobramento do campo cristalino.
Provas
Questão presente nas seguintes provas

Na hemoglobina, um íon Fe2+ se encontra coordenado a quatro átomos de nitrogênio de um anel porfirínico e a mais um nitrogênio de um grupo histidina que faz parte da proteína. A sexta posição na geometria octaédrica pode ser preenchida por uma molécula de O2 para formar a oxiemoglobina, responsável pelo transporte do O2 pela corrente sanguínea. De acordo com a teoria do campo cristalino, a oxiemoglobina consiste em um complexo de spin baixo. Por outro lado, se a molécula de O2 é substituída por uma molécula de H2O, tem-se então um complexo de spin alto. A figura precedente mostra os níveis de energia para os orbitais d antes e após o desdobramento pelo campo cristalino em um complexo octaédrico.
Com base nas informações e na figura apresentadas e considerando que a configuração eletrônica do íon Fe2+ é d6, julgue o item, de acordo com a teoria do campo cristalino.
A oxiemoglobina possui 4 elétrons desemparelhados e, por este motivo, apresenta comportamento paramagnético.
Provas
Questão presente nas seguintes provas

Na hemoglobina, um íon Fe2+ se encontra coordenado a quatro átomos de nitrogênio de um anel porfirínico e a mais um nitrogênio de um grupo histidina que faz parte da proteína. A sexta posição na geometria octaédrica pode ser preenchida por uma molécula de O2 para formar a oxiemoglobina, responsável pelo transporte do O2 pela corrente sanguínea. De acordo com a teoria do campo cristalino, a oxiemoglobina consiste em um complexo de spin baixo. Por outro lado, se a molécula de O2 é substituída por uma molécula de H2O, tem-se então um complexo de spin alto. A figura precedente mostra os níveis de energia para os orbitais d antes e após o desdobramento pelo campo cristalino em um complexo octaédrico.
Com base nas informações e na figura apresentadas e considerando que a configuração eletrônica do íon Fe2+ é d6, julgue o item, de acordo com a teoria do campo cristalino.
A partir das informações fornecidas, conclui-se que a molécula de H2O é um ligante de campo mais fraco do que a molécula de O2.
Provas
Questão presente nas seguintes provas
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.
!$ 2 \mathrm{H_2O_2}(aq) \overset{\mathrm{catalisador}}{ \longrightarrow} 2 \mathrm{H_2O} (\ell) + \mathrm{O_2} (g) !$
A
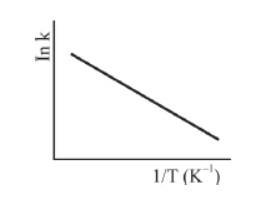
A figura precedente mostra o gráfico do logaritmo neperiano da constante de velocidade k da reação em função do recíproco da temperatura, sendo que a equação que descreve a reta obtida é !$ y = 30-3,0 \times 10^4 x !$.
Tabela I
| composto | ΔGº f (kJ/mol) |
| H2O2 (aq) | 134 |
| H2O (!$ \ell !$) | 237 |
| O2 (g) |
Tabela II
| ligação | Hº f (kJ/mol) |
| O—O | 157 |
| O=O | 496 |
| O—H | 463 |
Nas tabelas I e II são apresentadas, para uma temperatura de 25 ºC, as energias livres de Gibbs padrão de formação (ΔGºf) para as espécies envolvidas na reação e algumas entalpias padrão de ligação (HºR), respectivamente.
Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1, julgue o item subsequente, acerca da reação em questão.
As entalpias padrão de ligação fornecidas permitem determinar que a decomposição de 1,00 mol de H2O2, quando realizada à pressão constante de 1 bar e a 25 ºC, libera quantidade de calor superior a 100 kJ.
Provas
Questão presente nas seguintes provas
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.
!$ 2 \mathrm{H_2O_2}(aq) \overset{\mathrm{catalisador}}{ \longrightarrow} 2 \mathrm{H_2O} (\ell) + \mathrm{O_2} (g) !$

A figura precedente mostra o gráfico do logaritmo neperiano da constante de velocidade k da reação em função do recíproco da temperatura, sendo que a equação que descreve a reta obtida é !$ y = 30-3,0 \times 10^4 x !$.
Tabela I
| composto | ΔGº f (kJ/mol) |
| H2O2 (aq) | 134 |
| H2O (!$ \ell !$) | 237 |
| O2 (g) |
Tabela II
| ligação | Hº f (kJ/mol) |
| O—O | 157 |
| O=O | 496 |
| O—H | 463 |
Nas tabelas I e II são apresentadas, para uma temperatura de 25 ºC, as energias livres de Gibbs padrão de formação (ΔGºf) para as espécies envolvidas na reação e algumas entalpias padrão de ligação (HºR), respectivamente.
Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1, julgue o item subsequente, acerca da reação em questão.
A reação de decomposição do H2O2 libera maior quantidade de calor quando é realizada à pressão constante de 1 bar do que quando é realizada a volume constante.
Provas
Questão presente nas seguintes provas
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.
!$ 2 \mathrm{H_2O_2}(aq) \overset{\mathrm{catalisador}}{ \longrightarrow} 2 \mathrm{H_2O} (\ell) + \mathrm{O_2} (g) !$

A figura precedente mostra o gráfico do logaritmo neperiano da constante de velocidade k da reação em função do recíproco da temperatura, sendo que a equação que descreve a reta obtida é !$ y = 30-3,0 \times 10^4 x !$.
Tabela I
| composto | ΔGº f (kJ/mol) |
| H2O2 (aq) | 134 |
| H2O (!$ \ell !$) | 237 |
| O2 (g) |
Tabela II
| ligação | Hº f (kJ/mol) |
| O—O | 157 |
| O=O | 496 |
| O—H | 463 |
Nas tabelas I e II são apresentadas, para uma temperatura de 25 ºC, as energias livres de Gibbs padrão de formação (ΔGºf) para as espécies envolvidas na reação e algumas entalpias padrão de ligação (HºR), respectivamente.
Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1, julgue o item subsequente, acerca da reação em questão.
Em temperaturas mais elevadas, o valor da constante de equilíbrio da reação de decomposição do H2O2 é superior ao verificado em temperaturas mais baixas.
Provas
Questão presente nas seguintes provas
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.
!$ 2 \mathrm{H_2O_2}(aq) \overset{\mathrm{catalisador}}{ \longrightarrow} 2 \mathrm{H_2O} (\ell) + \mathrm{O_2} (g) !$

A figura precedente mostra o gráfico do logaritmo neperiano da constante de velocidade k da reação em função do recíproco da temperatura, sendo que a equação que descreve a reta obtida é !$ y = 30-3,0 \times 10^4 x !$.
Tabela I
| composto | ΔGº f (kJ/mol) |
| H2O2 (aq) | 134 |
| H2O (!$ \ell !$) | 237 |
| O2 (g) |
Tabela II
| ligação | Hº f (kJ/mol) |
| O—O | 157 |
| O=O | 496 |
| O—H | 463 |
Nas tabelas I e II são apresentadas, para uma temperatura de 25 ºC, as energias livres de Gibbs padrão de formação (ΔGºf) para as espécies envolvidas na reação e algumas entalpias padrão de ligação (HºR), respectivamente.
Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1, julgue o item subsequente, acerca da reação em questão.
O fato de a reação de decomposição do H2O2 ser de primeira ordem implica tratar-se de uma reação elementar.
Provas
Questão presente nas seguintes provas
Cadernos
Caderno Container