A seguir são apresentadas informações referentes à reação de decomposição do H2O2.
!$ 2 \mathrm{H_2O_2}(aq) \overset{\mathrm{catalisador}}{ \longrightarrow} 2 \mathrm{H_2O} (\ell) + \mathrm{O_2} (g) !$
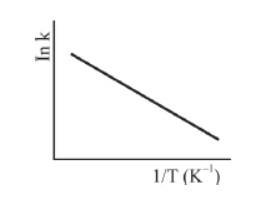
A figura precedente mostra o gráfico do logaritmo neperiano da constante de velocidade k da reação em função do recíproco da temperatura, sendo que a equação que descreve a reta obtida é !$ y = 30-3,0 \times 10^4 x !$.
Tabela I
| composto | ΔGº f (kJ/mol) |
| H2O2 (aq) | 134 |
| H2O (!$ \ell !$) | 237 |
| O2 (g) |
Tabela II
| ligação | Hº f (kJ/mol) |
| O—O | 157 |
| O=O | 496 |
| O—H | 463 |
Nas tabelas I e II são apresentadas, para uma temperatura de 25 ºC, as energias livres de Gibbs padrão de formação (ΔGºf) para as espécies envolvidas na reação e algumas entalpias padrão de ligação (HºR), respectivamente.
Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1, julgue o item subsequente, acerca da reação em questão.
A reação de decomposição do H2O2 libera maior quantidade de calor quando é realizada à pressão constante de 1 bar do que quando é realizada a volume constante.