Foram encontradas 60 questões.
Provas
Provas
Provas
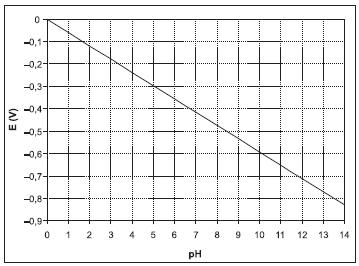
Provas
Provas
Considere o texto abaixo para responder a questão.
O termo espectroscopia se refere ao estudo da interação da matéria com ondas eletromagnéticas ou, mais amplamente, com fontes de energia, incluindo, também, feixes de partículas como elétrons. O espectro eletromagnético abrange desde ondas de rádio (grandes comprimentos de onda) até raios X (pequenos comprimentos de onda). Entre esses extremos, há a radiação na região do infravermelho (IV), do visível e do ultravioleta (UV). A região da luz visível é uma pequena parte do espectro eletromagnético, que compreende radiações entre, aproximadamente, 400 e 700 nm.
As técnicas espectroscópicas desempenharam um papel central na descoberta de novos elementos e, também, na evolução do conhecimento sobre a estrutura do átomo, como feito por Niels Bohr, ao estudar os espectros de absorção e emissão dos átomos.
O princípio da espectroscopia fotoeletrônica se baseia no efeito fotoelétrico, descoberto no final do século XIX por Heinrich Hertz. Nesse princípio, a incidência de luz na superfície de um metal levava à indução de corrente elétrica. Se um experimento semelhante é realizado no estado gasoso, pode-se medir a energia de ionização de um elemento: o fóton da luz incidente transfere energia para o elétron, que é ejetado. A diferença de energia do fóton e do elétron ejetado é a energia de ionização do elemento. Considere as afirmativas abaixo sobre esses experimentos.
I – A energia de cada fóton que incidirá na superfície metálica é independente da intensidade da luz.
II – Para que o efeito fotoelétrico seja observado no sódio, necessita-se de um maior comprimento de onda que o utilizado para o potássio.
III – O comprimento de onda necessário para que haja o efeito fotoelétrico aumentará com a dificuldade em ejetar os elétrons.
IV – Para um mesmo elemento, quanto menor o comprimento de onda da luz incidente, maior será a energia cinética do primeiro elétron ejetado.
Estão corretas APENAS as afirmativas
Provas
Considere o texto abaixo para responder a questão.
O termo espectroscopia se refere ao estudo da interação da matéria com ondas eletromagnéticas ou, mais amplamente, com fontes de energia, incluindo, também, feixes de partículas como elétrons. O espectro eletromagnético abrange desde ondas de rádio (grandes comprimentos de onda) até raios X (pequenos comprimentos de onda). Entre esses extremos, há a radiação na região do infravermelho (IV), do visível e do ultravioleta (UV). A região da luz visível é uma pequena parte do espectro eletromagnético, que compreende radiações entre, aproximadamente, 400 e 700 nm.
As técnicas espectroscópicas desempenharam um papel central na descoberta de novos elementos e, também, na evolução do conhecimento sobre a estrutura do átomo, como feito por Niels Bohr, ao estudar os espectros de absorção e emissão dos átomos.
Os espectros de absorção e emissão na região da luz visível para o átomo de hidrogênio foram estudos feitos por Balmer. Nessa região do espectro eletromagnético, ele observou um conjunto de quatro linhas: 656 nm, 486 nm, 434 nm e 410 nm.
Considerando-se que as transições eletrônicas observadas por Balmer no espectro de absorção partem do segundo nível energético do átomo de hidrogênio, a absorção da radiação de comprimento de onda de 656 nm leva o elétron ao
Provas
Provas
Provas
Provas
Caderno Container