Foram encontradas 30 questões.
Sob a bancada de um laboratório foram encontrados três frascos cujos rótulos indicavam conter acetato de sódio, cloreto de amônio e cloreto de potássio. A fórmula molecular de um dos sais encontrados, cuja solução aquosa apresenta pH ácido, é
Provas
O termo metais pesados tem sido utilizado para caracterizar um grupo de elementos químicos, tendo como base a densidade atômica maior que 6,0 g m-3. Esses elementos geralmente encontram-se associados a problemas relativos à poluição, à contaminação e à toxicidade quando dispostos indevidamente no ambiente. Um método analítico amplamente utilizado para a detecção qualitativa e para a determinação quantitativa desses elementos é a absorção atômica por chama. Considerando os princípios desse método analítico, é INCORRETO afirmar que
Provas
Um pedaço de esponja de aço usada em limpeza doméstica e uma pequena lâmina, também de aço, ambas com a mesma massa, foram deixadas expostas ao ar sob as mesmas condições ambientais. Após um determinado tempo, ambas sofreram o processo de oxidação descrito pela seguinte equação geral:
2 Fe + O2 + 2 H2O → 2 Fe(OH)2
Entretanto, observou-se maior velocidade da reação de oxidação na esponja do que na lâmina. Nessa experiência, o fator que determinou a diferença de velocidade da reação de oxidação nos dois materiais foi a(o)
Provas
Um procedimento comum em indústrias e laboratórios é o preparo, para diversos fins, de uma solução a partir da mistura de outras soluções do mesmo composto, porém de concentrações e volumes diferentes. Assim, a massa de NaOH, em gramas, contida na solução formada após a mistura de 300 mL de solução 0,5 N de NaOH a 600 mL de uma outra solução de NaOH 0,2 M será
(Massas atômicas: Na = 23; O = 16; H = 1)
Provas
A titulometria de neutralização compreende titulações de espécies ácidas com solução padrão alcalina e titulações de espécies básicas com solução padrão ácida. Têm-se, assim, duas variantes da titulometria de neutralização, a alcalimetria e a acidimetria, respectivamente. Numa análise titulométrica, foi obtida a curva de neutralização apresentada na figura abaixo.

Observando a curva, verifica-se que o ponto de equivalência da reação
Provas
Em um laboratório de análises químicas, foi realizada uma série de ensaios com amostras de 3 substâncias distintas, X, Y e Z, em que foram determinadas algumas de suas propriedades, como pode ser visto no quadro abaixo.
|
Substância |
|||
| X | Y | Z | |
|
D(g/cm3) |
2,1 | 0,7 | 0,8 |
|
PF(ºC) |
98 | -40 |
-18 |
|
PE(ºC) |
252 | 76 |
85 |
|
Solubilidade em água a 25 ºC |
solúvel | insolúvel |
insolúvel |
|
Solubilidade em acetona a 25 ºC |
insolúvel | solúvel |
solúvel |
Com base nos resultados obtidos, foram feitas as seguintes afirmações:
I – à temperatura ambiente, todas as substâncias encontram- se no estado líquido;
II – a substância que apresenta menor pressão de vapor, à temperatura ambiente, é Y;
III – um processo adequado para separar uma mistura das substâncias Y e Z solubilizadas em acetona é a destilação fracionada;
IV – uma mistura das substâncias X, Z e água forma um sistema homogêneo.
Estão corretas SOMENTE as afirmativas
Provas
A equação geral que representa a reação de obtenção do metilpropionato de n-butila é descrita a seguir.
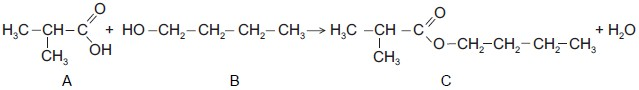
Sobre essa reação e seus componentes, reagentes e produtos, foram feitas as seguintes afirmativas:
I – é uma reação de condensação, conhecida como esterificação;
II – B é o n-butanol, um álcool de fórmula molecular C4H10O, que apresenta ponto de ebulição maior que o n-butano;
III – A é um aldeído e apresenta cadeia ramificada com um carbono terciário;
IV – o metilpropionato de n-butila, C, é um éter que sofre saponificação quando reage com hidróxido de sódio.
Estão corretas APENAS as afirmativas
Provas
Os processos de tratamento dos efluentes industriais podem ser classificados em físicos, químicos e biológicos, em função da natureza dos poluentes a serem removidos e ou das operações unitárias utilizadas para o tratamento. Os processos biológicos visam, principalmente, à remoção da matéria orgânica em suspensão (coloidal ou sedimentável) e dissolvida, bem como à redução da presença de micro-organismos. De acordo com o exposto, apresentam apenas processos biológicos de tratamento de efluentes:
Provas
Uma das principais medidas de segurança para dificultar a falsificação de cédulas é a inclusão de raiom, um fio sintético fabricado com a fibra de celulose entre as várias camadas que compõem o papel-moeda. A celulose é um polímero natural formado a partir de monossacarídeos ligados entre si através de reações de
Provas
Alguns compostos organometálicos são utilizados como catalisadores em processos industriais devido à sua reatividade e aos tipos de reações a que podem ser submetidos. Sobre os mecanismos envolvidos no processo de catálise, considere as seguintes afirmações:
I – os catalisadores conduzem as reações por mecanismos de energias de ativação mais altos, fazendo aumentar as suas velocidades, sem serem consumidos durante o processo;
II – uma reação termodinamicamente desfavorável (!$ \Delta !$G0 > 0) pode se tornar favorável (!$ \Delta !$G0 < 0) na presença de um catalisador, sendo !$ \Delta !$G0 a variação da energia livre de Gibbs no estado padrão;
III – a entalpia de ativação e a entropia de ativação são funções de estado relacionadas, respectivamente, com a formação ou a quebra de ligações químicas e com o grau de desordem no estado de transição de uma reação química;
IV – na catálise homogênea, o catalisador e os reagentes se encontram na mesma fase, em solução, por exemplo.
Estão corretas APENAS as afirmações
Provas
Caderno Container